កោសិកាដើម
កោសិកាដើម (-細胞, 영어 : </link> ) គឺជា កោសិកាដែលមិនមានភាពខុសគ្នា ដែលអាចបែងចែកទៅជាប្រភេទជាច្រើននៃ ជាលិកា នៅក្នុង អំប្រ៊ីយ៉ុង ឬមនុស្សពេញវ័យ។ តាមពិតវាសំដៅទៅលើ កោសិកា pluripotent មុនពេលសម្រាល។ កោសិកាដើមត្រូវបានប្រមូលជាចម្បងពី អំប្រ៊ីយ៉ុង ក្នុងដំណាក់កាលដំបូងនៃការបែងចែក។ ដោយសារ កោសិកា នៅដំណាក់កាលនេះមិនទាន់មានលទ្ធភាពបង្កើតសរីរាង្គនៅឡើយ ពួកវាអាចត្រូវបានបង្កាត់ចូលទៅក្នុងកោសិកាដែលបានជ្រើសរើសជាពិសេសដោយផ្អែកលើការបញ្ចូលពីមុន។ ហៅផងដែរថា hepatocytes ឬកោសិកា ម្តាយ ។ បច្ចុប្បន្ននេះ ការស្រាវជ្រាវកោសិកាដើមកំពុងត្រូវបានធ្វើឡើងក្នុងការប្រកួតប្រជែងក្នុងប្រទេសជុំវិញពិភពលោក។ ប្រសិនបើបច្ចេកវិទ្យាត្រូវបានធានាដើម្បីអនុញ្ញាតឱ្យមនុស្សគ្រប់គ្រងកោសិកាដើមបានត្រឹមត្រូវ នោះពិភពថ្មីនៃការព្យាបាលជម្ងឺនឹងបើកចំហ។ នេះក៏ព្រោះតែការប្តូរសរីរាង្គអាចធ្វើបានយ៉ាងងាយ។ មានពីរប្រភេទ៖ កោសិកាដើមអំប្រ៊ីយ៉ុង និងកោសិកាដើមពេញវ័យ។ កោសិកាដើមអំប្រ៊ីយ៉ុងមានចរិតលក្ខណៈដែលអាចបែងចែកទៅជាកោសិកាទាំងអស់ ចំណែកកោសិកាដើមពេញវ័យមានចរិតលក្ខណៈនៃការបំបែកទៅជាកោសិកាជាក់លាក់ប៉ុណ្ណោះ។
សូមមើលផងដែរ
កែប្រែសមត្ថភាពបែងចែកនៃកោសិកាដើមអំប្រ៊ីយ៉ុងមានដូចខាងក្រោម។
កោសិកាដើមមនុស្សពេញវ័យ / កោសិកាដើមជាក់លាក់នៃជាលិកា
កែប្រែសម្រួលការបកប្រែដោយ និស្សិត ស្រួ យុុទ្ធធឿន
Totipotency - សំដៅលើសមត្ថភាពក្នុងការបែងចែកទៅជា បុគ្គល ហើយ កោសិកា នីមួយៗអាចបែងចែកទៅ ជាបុគ្គល ។ នេះគឺដូចគ្នានឹងពេលស៊ុតបង្កកំណើតបំបែកនៅដំណាក់កាលដំបូងនៃការមានផ្ទៃពោះ ដោយបង្កើតបាន កូនភ្លោះ ដូចគ្នា។
ភាពខុសគ្នានៃសក្តានុពលនៃកោសិកាដើមអំប្រ៊ីយ៉ុង
កែប្រែPluripotency - សំដៅលើសមត្ថភាពក្នុងការបែងចែកទៅជាកោសិកាទាំងអស់របស់ទារកឬមនុស្សពេញវ័យ។ វាគឺជាកោសិកាមួយនៅដំណាក់កាលមុនការខុសប្លែកគ្នាទៅជាសរីរាង្គផ្សេងៗនៅពេលដែលស៊ុតបង្កកំណើតដំបូងបានបែងចែក។ កោសិកាទាំងនេះបែងចែកទៅជាសរីរាង្គផ្សេងៗដូចជាបេះដូង លំពែង ថ្លើម។ ស្បែក សរសៃប្រសាទ ។ល។
Multipotent - សមត្ថភាពក្នុងការបែងចែកទៅជាប្រភេទកោសិកាជាច្រើនដែលជាកម្មសិទ្ធិរបស់ពូជកោសិកាហើយត្រូវបានស្រង់ចេញពីកោសិកាដើមពេញវ័យ។
Bipotent - សំដៅលើកោសិកាដើមដែលអាចបែងចែកទៅជាកោសិកាពីរប្រភេទ។
Unipotent - សំដៅលើកោសិកាដើមដែលអាចបែងចែកទៅជាកោសិកាជាក់លាក់មួយប្រភេទ។
កោសិកាដើមទាំងនេះមានក្នុងបរិមាណតិចតួចបំផុតនៅក្នុង ជាលិកា នីមួយៗនៃរាងកាយ។ កោសិកាដែលបង្កើតជាជាលិកាជាក់លាក់គឺជាកោសិកាដែលត្រូវបានកំណត់ឱ្យខុសគ្នាតែចូលទៅក្នុងណឺរ៉ូន olfactory ដូចជាកោសិកាខួរឆ្អឹងចូលទៅក្នុងកោសិកាឈាម កោសិកាដើមស្បែកចូលទៅក្នុង ស្បែក និងណឺរ៉ូន olfactory ទៅជាសរសៃប្រសាទ olfactory ។ ឧទាហរណ៍តំណាងគឺ កោសិកាដើម hematopoietic pluripotent ។ វាគឺជា កោសិកា ដែលផ្តល់ចំនួន កោសិកា អប្បបរមាដែលត្រូវការដើម្បីរក្សារាងកាយរបស់យើងឱ្យមានសុខភាពល្អគ្រប់ពេលវេលា។ នៅពេលដែលការខូចខាតខ្លះកើតឡើង កោសិកាដើមពីសរីរាង្គផ្សេងទៀតបានចូលមក និង បំប្លែង ទៅជាជាលិកាដែលខូច។ ចាប់តាំងពីភាពខុសគ្នាមានស្ថេរភាព វាមិនមានលទ្ធភាពនៃកោសិកាមហារីកទេ ហើយការអនុវត្តគ្លីនិកបានឈានដល់រួចហើយ។ មិនដូចកោសិកាដើមអំប្រ៊ីយ៉ុងទេ វាមិនមានការបំផ្លិចបំផ្លាញនៃស៊ុតបង្កកំណើតទេ ដូច្នេះមិនមានបញ្ហា សីលធម៌ ទេ។ ទោះជាយ៉ាងណាក៏ដោយ ចំនួនកោសិកាដើមដែលអាចទទួលបានមានតិចតួច ពិបាកក្នុងការដាំដុះ ហើយពួកវាអាចបែងចែកទៅជាកោសិកាជាក់លាក់ប៉ុណ្ណោះ ហើយពួកគេមិនអាចបរិច្ចាគបានទេដោយសារតែការបដិសេធនៃប្រព័ន្ធភាពស៊ាំ។
កោសិកាដើមរួមមាន កោសិកាដើមអំប្រ៊ីយ៉ុង ដោយប្រើ អំប្រ៊ីយ៉ុង របស់មនុស្ស កោសិកាដើមពេញវ័យដូចជាកោសិកាខួរឆ្អឹងដែល បន្តផលិតកោសិកាឈាម និង កោសិកាដើម pluripotent (កោសិកា iPS) ដោយប្រើ កោសិកា somatic មនុស្ស ។
កោសិកាដើម Pluripotent ដែលបង្កឡើង - កោសិកា iPS ឬ iPSCs
កែប្រែកោសិកាដើមទាំងនេះត្រូវបានគេហៅថាជាកោសិកា IPS ហើយមានអត្ថប្រយោជន៍ក្នុងការបំបែកទៅជា កោសិកាដើមដែលមានលក្ខណៈសម្បត្តិដូចគ្នាទៅនឹងកោសិកាដើមអំប្រ៊ីយ៉ុង មិនថាពួកវាត្រូវបានគេប្រើនៅក្នុងរាងកាយនៅកន្លែងណាក៏ដោយ។ វាក៏ត្រូវបានគេប្រើជា ការចាប់ផ្តើម ឬ dedifferentiation ហើយអត្ថន័យនៃទាំងពីរគឺស្ទើរតែដូចគ្នា។ ក្នុងឆ្នាំ 2007 ក្រុម Yamanaka ដឹកនាំដោយអ្នកវិទ្យាសាស្ត្រជប៉ុន Shinya Yamanaka បានទទួលជោគជ័យក្នុងការផ្លាស់ប្តូរភាពខុសគ្នាដោយប្រើសត្វកណ្តុរជាលើកដំបូង ដោយផ្តល់ក្តីសង្ឃឹមថាកោសិកាដើមដូចជាកោសិកាដើមអំប្រ៊ីយ៉ុងអាចបង្កើតបានដោយប្រើផ្នែកណាមួយនៃរាងកាយមនុស្សក្នុងសតវត្សទី 21 នេះ។ គឺជាសមិទ្ធិផលដ៏អស្ចារ្យមួយក្នុងជីវបច្ចេកវិទ្យា។ នេះគឺជារបាយការណ៍ដែលអាចផ្តល់ក្តីសង្ឃឹមដ៏អស្ចារ្យក្នុងការដុតអ្នកជំងឺ អ្នកជំងឺដែលបាត់បង់អវយវៈ និងអ្នកជំងឺខ្វិនឆ្អឹងខ្នង។ ប្រទេសជប៉ុនបាននាំមុខមុនក្នុងវិស័យនេះ ប៉ុន្តែនៅទីបំផុតសហរដ្ឋអាមេរិកបាននាំមុខគេក្នុងវិស័យកោសិកាដើមទាំងអស់។
ការព្យាបាលដោយម៉ាទ្រីសក្រៅកោសិកា
កែប្រែការព្យាបាលដោយម៉ាទ្រីស Extracellular គឺជាការព្យាបាលដោយផ្អែកលើម្សៅដែលចម្រាញ់ចេញពីប្លោកនោមជ្រូក ហើយបច្ចុប្បន្នកំពុងត្រូវបានសាកល្បងជាមួយនឹងសម្ភារៈផ្សេងៗ។ វាកំពុងលេចចេញជាមេកាសម្រាប់ការព្យាបាលកោសិកាដើម ដោយលទ្ធផលស្រាវជ្រាវបង្ហាញថាម្រាមដៃដែលខូចត្រូវបានស្ដារឡើងវិញ 100% ដល់សភាពដើមរបស់វា រួមទាំងសរសៃប្រសាទ ជាមួយនឹងការព្យាបាលដែលត្រូវបានរចនាឡើងដោយផ្អែកលើសមត្ថភាពបង្កើតឡើងវិញរបស់សត្វចចក និងរបាយការណ៍អំពីស្បែករបស់អ្នកជំងឺរលាក។ ងើបឡើងវិញជិត 100% ទាំងស្រុង។ ទោះជាយ៉ាងណាក៏ដោយ គេរំពឹងថាវានឹងក្លាយទៅជាការពេញនិយមបន្ទាប់ពីការស្រាវជ្រាវប្រហែល 13 ឆ្នាំ។ ការស្រាវជ្រាវកោសិកាដើមទាំងអស់ត្រូវតែធ្វើឡើងពីទស្សនៈជាច្រើន ហើយវិធីសាស្ត្រព្យាបាលម៉ាទ្រីស extracellular គឺគ្រាន់តែជាវិធីមួយក្នុងចំនោមពួកគេប៉ុណ្ណោះ។
Hematopoietic Stem Cells កោសិកាដើម Hematopoietic មានគុណសម្បត្តិងាយស្រួលក្នុងការបំបែក និងបន្សុទ្ធចេញពី ទងផ្ចិត ឬ ខួរឆ្អឹង ហើយងាយស្រួលក្នុងការបែងចែកមុននឹងផ្តល់ដល់អ្នកជំងឺ។ Metachromatic leukodystrophy គឺជាជំងឺដែលបណ្តាលឱ្យប្រកាច់ និងខ្សោយសាច់ដុំដោយសារតែកង្វះអង់ស៊ីម Arylsulfatase A។ បច្ចុប្បន្នវាត្រូវបានគេស្គាល់ថាជាជំងឺដែលមិនអាចព្យាបាលបាន ហើយការស្លាប់ត្រូវបានគេដឹងថាកើតឡើង 2-3 ឆ្នាំបន្ទាប់ពីការចាប់ផ្តើម។ ក្នុងឆ្នាំ 2013 ក្រុមស្រាវជ្រាវរបស់វេជ្ជបណ្ឌិត Luigi Naldini នៅវិទ្យាស្ថានវិទ្យាសាស្ត្រ San Raffaele បានប្រើ Lantivirus ដើម្បីណែនាំហ្សែន arylsufatase A ចូលទៅក្នុងកោសិកាដើម hematopoietic ដែលស្រង់ចេញពីខួរឆ្អឹង និងឈាមគ្រឿងកុំព្យូទ័ររបស់អ្នកជំងឺ ហើយបានគ្រប់គ្រងវាដល់អ្នកជំងឺវ័យក្មេងក្នុងដំណាក់កាលដំបូងនៃជំងឺនេះ ( ការចាក់បញ្ចូលតាមសរសៃឈាម) ។ ជាលទ្ធផល មិនត្រឹមតែសកម្មភាពរបស់អង់ស៊ីមដែលត្រូវគ្នាកើនឡើងប៉ុណ្ណោះទេ ថែមទាំងរោគសញ្ញានៃភាពទន់ខ្សោយសាច់ដុំត្រូវបានធូរស្រាល ដែលបង្ហាញថាវាអាច ព្យាបាលជំងឺមហារីកឈាមរបស់មនុស្ស ដោយប្រើកោសិកាដើម hematopoietic ។ [១]
កែប្រែវាមានប្រភពចេញពី ស៊ុត បង្កកំណើត ដែលត្រូវបានបង្កើតឡើងតាមរយៈការបង្កកំណើតនៃកោសិកាបន្តពូជបុរស មេជីវិត ឈ្មោល និងកោសិកាបន្តពូជរបស់ស្ត្រី ដែលជាស៊ុតមួយ។ នៅពេលដែលទារកលូតលាស់នៅក្នុងផ្ទៃម្តាយ កោសិកា ប្រហែល 2 ពាន់ពាន់លានត្រូវបានបង្កើតឡើង ហើយកោសិកាដើមអំប្រ៊ីយ៉ុងមានសមត្ថភាពបែងចែកទៅជាប្រភេទផ្សេងៗនៃ កោសិកា ។ ហៅផងដែរថា កោសិកាដើម pluripotent ... ការរីកសាយដ៏ធំគឺអាចធ្វើទៅបាន ភាពខុសគ្នាចូលទៅក្នុងកោសិការាងកាយស្ទើរតែទាំងអស់គឺអាចធ្វើទៅបាន ហើយមិនមានការបដិសេធនៃប្រព័ន្ធភាពស៊ាំទេ។ ទោះជាយ៉ាងណាក៏ដោយ ដោយសារតែការគ្រប់គ្រងភាពខុសគ្នាគឺពិបាក និងមានលទ្ធភាពដែលពួកវាអាចប្រែទៅជាកោសិកាមហារីក បច្ចេកវិទ្យាទាមទារភាពជាក់លាក់ ហើយបញ្ហា សីលធម៌ អាចនឹងត្រូវបានលើកឡើងដោយសារតែការបំផ្លាញស៊ុតបង្កកំណើត។
ឯកសារយោង
កែប្រែការព្យាបាលដោយហ្សែន គឺជាវិធីសាស្ត្រព្យាបាលដែលព្យាបាលពិការភាពហ្សែន ឬបន្ថែមមុខងារថ្មីដោយបន្ថែមហ្សែនដែលទាក់ទងនឹងជំងឺជាក់លាក់មួយទៅកាន់កោសិកា។ ដើម្បីបន្ថែមហ្សែនទៅកោសិកា នាវាផ្ទុកគឺត្រូវការជាចាំបាច់ ហើយមេរោគដើរតួនាទីជាក្រុមហ៊ុនបញ្ជូននេះ។
កោសិកាដើមមានសមត្ថភាពក្នុងការបន្តដោយខ្លួនឯង ដែលអាចកាត់បន្ថយដំណើរការព្យាបាលដ៏លំបាក និងចំនួននៃការព្យាបាល ដែលជាបញ្ហាជាមួយនឹងការព្យាបាលដោយហ្សែនដែលមានស្រាប់។ ដូច្នេះហើយ ពួកគេត្រូវបានទទួលស្គាល់ថាមានសក្តានុពលជាសម្ភារៈដ៏ល្អសម្រាប់ការព្យាបាលហ្សែន ទោះបីជា មិនមានការស្រាវជ្រាវច្រើនទេ។ រហូតមកដល់បច្ចុប្បន្ន ការព្យាបាលដោយហ្សែនដោយប្រើកោសិកា ដើម មនុស្សពេញវ័យកំពុងត្រូវបានស្រាវជ្រាវជាចម្បង ដូចដែលបានរៀបរាប់ខាងក្រោម។
ដែនកំណត់
កែប្រែAdrenoleukodystrophy (ALD) គឺជាជំងឺធ្ងន់ធ្ងរដែលអាស៊ីតខ្លាញ់ខ្សែសង្វាក់វែងខ្លាំងមិនត្រូវបានបំបែកយ៉ាងត្រឹមត្រូវ និងនៅតែមាននៅក្នុងប្រព័ន្ធសរសៃប្រសាទ ប៉ះពាល់ដល់ប្រព័ន្ធសរសៃប្រសាទ និងក្រពេញ Adrenal ។ ក្នុងឆ្នាំ 2017 ក្រុមស្រាវជ្រាវរបស់សាស្រ្តាចារ្យ David A. Williams នៅសាលាវេជ្ជសាស្ត្រ Harvard បានរាយការណ៍ពីវិធីសាស្រ្តក្នុងការព្យាបាលការផ្លាស់ប្តូរ ABCD1 (ATP-binding cassette (ABC) transporters) ដែលបណ្តាលឱ្យ adrenoleukodystrophy ដោយណែនាំហ្សែន ABCD1 ធម្មតាដោយប្រើ lentivirus ស្រដៀងនឹងវិធីសាស្ត្រមុនដែរ។ តាមរយៈនេះ វាត្រូវបានបញ្ជាក់ថាការវិវត្តនៃជំងឺត្រូវបានបញ្ឈប់ក្នុងអ្នកជំងឺ 15 នាក់ក្នុងចំណោម 17 នាក់ (88%) ក្នុងរយៈពេលប្រហែល 2 ឆ្នាំនៃការព្យាបាល។ [២] ដោយសារតែការព្យាបាលហ្សែនទាំងពីរបានប្រើកោសិកាដើម hematopoietic ផ្ទាល់របស់អ្នកជំងឺ ពួកគេមិនបង្កឱ្យមាន ជំងឺពុករលួយ ធៀបនឹងម៉ាស៊ីន ដែលជាជំងឺប្រព័ន្ធភាពស៊ាំ ហើយបានបង្ហាញពីបាតុភូតនៃការបន្ថយរោគសញ្ញាជំងឺ និងបញ្ឈប់ការវិវត្តនៃជំងឺដោយប្រើកោសិកាដើម។ វាត្រូវបានបង្ហាញថា ការព្យាបាលដោយហ្សែន អាចត្រូវបានប្រើដើម្បីព្យាបាលជំងឺរបស់មនុស្ស រួមទាំងជំងឺដែលមិនអាចព្យាបាលបាន។
បន្ថែមពីលើកោសិកាដើម hematopoietic ដែលស្រង់ចេញដោយផ្ទាល់ពីខួរឆ្អឹងរបស់អ្នកជំងឺ ការព្យាបាលដោយហ្សែនដោយប្រើ កោសិកាដើម pluripotent ដែលបណ្ដាលមកពីអ្នកជំងឺ និង CRISPR-CAS9 ដែលជាកន្ត្រៃហ្សែនជំនាន់ទីបីក៏ត្រូវបានរាយការណ៍ផងដែរ។ ដោយប្រើ CRISPR-CAS9 ហ្សែន mutant នៃ កោសិកាដើម pluripotent ដែលបង្កឡើងពីអ្នកជំងឺត្រូវបានត្រឡប់មកធម្មតាវិញ ហើយត្រូវបានបែងចែកទៅជាកោសិកាដើម hematopoietic នៅក្នុងខ្លួន។ នៅពេលដែលត្រូវបានគ្រប់គ្រងលើសត្វកណ្តុរដែលមានជំងឺដែលបណ្តាលមកពីការផ្លាស់ប្តូរ មិនត្រឹមតែហ្សែនធម្មតា និងការបញ្ចេញប្រូតេអ៊ីនប៉ុណ្ណោះទេ។ ប៉ុន្តែក៏ការការពារជំងឺផងដែរ រោគសញ្ញាត្រូវបានបង្ហាញថាបានធូរស្រាល។ [៣] ទោះបីជាយ៉ាងណាក៏ដោយ ដោយសារតែ CRISPR-CAS9 មានឥទ្ធិពលក្រៅគោលដៅនៅពេលកែសម្រួលហ្សែនក្រៅពីហ្សែនដែលចង់បាន ការស្រាវជ្រាវបន្ថែមទំនងជាត្រូវការដើម្បីអនុវត្តវាចំពោះមនុស្ស។
កោសិកាដើមអំប្រ៊ីយ៉ុង
កែប្រែGlioma គឺជាដុំសាច់ដែលកើតឡើងនៅក្នុងខួរក្បាល វាត្រូវបានគេស្គាល់ថាជាជំងឺដែលពិបាកព្យាបាលព្រោះកោសិកាដុំសាច់ទាំងនេះបំផ្លាញជាលិកាខួរក្បាលធម្មតា និងផ្លាស់ទីជុំវិញខួរក្បាល។ ក្នុងឆ្នាំ 2016 ក្រុមស្រាវជ្រាវរបស់សាស្រ្តាចារ្យ Hingtgen នៅសាកលវិទ្យាល័យ North Carolina បានប្រើវ៉ិចទ័រ lentiviral នៅក្នុងកោសិកាដើមសរសៃប្រសាទ (iNSC) ដើម្បីធ្វើឱ្យដំណើរការ TRAIL (Tumor Necrosis Factor-) ដែលបណ្តាលឱ្យកោសិកាស្លាប់ដោយការធ្វើឱ្យសកម្មនៃការទទួលមរណភាពនៃកោសិកាមហារីក។ វិធីសាស្រ្តព្យាបាលហ្សែនដែលហ្សែនមួយ (ទាក់ទងនឹង Apoptosis-Inducing Ligand) ត្រូវបានណែនាំ និងចាក់ចូលទៅក្នុងខួរក្បាលរបស់កណ្តុរដែលមាន glioma របស់មនុស្ស។ ជាលទ្ធផលវាត្រូវបានគេរកឃើញថាទំហំនៃដុំសាច់នៅក្នុងខួរក្បាលរបស់សត្វកណ្តុរដែលមាន glioma ត្រូវបានកាត់បន្ថយយ៉ាងខ្លាំងក្នុងរយៈពេលពីរសប្តាហ៍ដែលបង្ហាញពីលទ្ធភាពនៃការព្យាបាល glioma ដែលជាជំងឺដែលមិនអាចព្យាបាលបានចំពោះមនុស្ស។ [៤]
ខណៈពេលដែលមនុស្សជាច្រើនបានបង្កើតការព្យាបាលដោយហ្សែនកោសិកាដើមដោយការបញ្ចូលវ៉ិចទ័រមេរោគជាមួយនឹងហ្សែនធម្មតា ក្រុមស្រាវជ្រាវរបស់វេជ្ជបណ្ឌិត Karen Aboody នៅមជ្ឈមណ្ឌលវេជ្ជសាស្ត្រ City of Hope បានទាក់ទងការព្យាបាលដោយហ្សែនដោយប្រើកោសិកាដើមដោយប្រើវិធីផ្សេង ការព្យាបាលដោយអង់ស៊ីម និងប្រូឌីក។ 5-fluorocytosine (5-FC) ដែលគេស្គាល់ថាជាការព្យាបាល glioma ត្រូវបានបំប្លែងទៅជា 5-fluorouracil ដោយអង់ស៊ីម cytosine deaminase (CD) និងសម្លាប់កោសិកាមហារីកដែលបែងចែកជុំវិញ។ ក្រុមស្រាវជ្រាវរបស់វេជ្ជបណ្ឌិត Karen Aboody បានប្រើមេរោគ retrovirus ដើម្បីណែនាំ CD ចូលទៅក្នុងកោសិកាសរសៃប្រសាទ និងបានគ្រប់គ្រងវាទៅខួរក្បាលរបស់មនុស្សដែលមានជំងឺសាហាវ (កម្រិតខ្ពស់ glioma) ។ អាយុកាល។ [៥]
កោសិកាដើមសរសៃប្រសាទ
កែប្រែកោសិកាដើម Mesenchymal គឺជាកោសិកាដើមដែលងាយស្រួលក្នុងការទាញយកចេញពីខួរឆ្អឹង ជាលិកា adipose និងទងផ្ចិត ហើយត្រូវបានគេស្គាល់ថាប្រមូលផ្តុំនៅក្នុងជាលិកាដែលខូច ឬរលាក និងជាលិកាមហារីក។ នោះហើយជាមូលហេតុដែលពួកវាត្រូវបានប្រើប្រាស់រួចហើយនៅក្នុង ឱសថ បង្កើតឡើងវិញ និងដើម្បីព្យាបាល ជំងឺពុករលួយ ។ ដោយសារ កោសិកាដើម mesenchymal ក៏កកកុញនៅក្នុងជាលិកាមហារីក វាមានលទ្ធភាពដែលពួកវាអាចត្រូវបានប្រើសម្រាប់ការព្យាបាលហ្សែន។ ទោះជាយ៉ាងណាក៏ដោយ នេះមិនទាន់ត្រូវបានរាយការណ៍នៅឡើយទេ ហើយក្រុមរបស់វេជ្ជបណ្ឌិត Keiya Ozawa ណែនាំថា ការណែនាំនៃហ្សែនដែលបង្កើត ដុំសាច់មហារីក necrosis factor alpha អាចត្រូវបានប្រើសម្រាប់ការព្យាបាលដោយហ្សែនដោយប្រើ កោសិកាដើម mesenchymal ។ [៦]
ដំណាក់កាលសាកល្បងព្យាបាលសត្វ
កែប្រែការព្យាបាលដោយប្រើកោសិកាដើមមានបញ្ហាដូចជា ការច្រានចោលនូវភាពស៊ាំ ការចំណាកស្រុកទៅកាន់ជាលិកាផ្សេងទៀត និងភាពខុសគ្នាខុស ហើយកោសិកាដើមប្រែទៅជាកោសិកាមហារីក។ ក្នុងករណីការព្យាបាលដោយហ្សែន ដោយសារវាប្រើប្រាស់មេរោគ វាមានបញ្ហាដូចជាការពុល និងការឆ្លើយតបរលាកដែលបណ្តាលមកពីមេរោគ ការផ្លាស់ប្តូរដោយសារតែការបញ្ចូលហ្សែន និងដូចជាការព្យាបាលដោយកោសិកាដើម វាអាចបណ្តាលឱ្យមានការបដិសេធនៃប្រព័ន្ធភាពស៊ាំ។ ដោយសារការព្យាបាលដោយហ្សែនដោយប្រើកោសិកាដើមគឺជាការរួមបញ្ចូលគ្នានៃការព្យាបាលទាំងពីរនេះ វាចែករំលែកបញ្ហានៃវិធីព្យាបាលទាំងពីរ។ ក្រៅពីហានិភ័យជីវសាស្ត្រ និងឥទ្ធិពលព្យាបាល វាក៏មានគុណវិបត្តិនៃការចំណាយថ្លៃព្យាបាលផងដែរ។
លើសពីនេះទៀត ដោយសារកោសិកាដើមស្ថិតនៅក្នុងរាងកាយរយៈពេលយូរ ផលប៉ះពាល់ត្រូវតែត្រូវបានត្រួតពិនិត្យតាមពេលវេលា ហើយការសង្កេត និងការស្រាវជ្រាវបន្ថែមគឺចាំបាច់ដើម្បីកាត់បន្ថយជំងឺ និងរក្សាប្រសិទ្ធភាពព្យាបាល។
ប្រភេទនៃការព្យាបាលកោសិកាដើមមនុស្សពេញវ័យ
កែប្រែកោសិកាដើមនៅក្នុងន័យបុរាណមានលក្ខណៈសម្បត្តិពីរ។ ការចម្លងដោយខ្លួនឯង៖ សមត្ថភាពក្នុងការឆ្លងកាត់ការបែងចែកកោសិកាជាច្រើនខណៈពេលដែលនៅសល់មិនមានលក្ខណៈខុសគ្នា។ សក្ដានុពលនៃភាពខុសគ្នា៖ សមត្ថភាពក្នុង ការបែងចែក ទៅជាប្រភេទផ្សេងៗនៃកោសិកាជាក់លាក់។ ក្នុងន័យតឹងរឹង វាចាំបាច់ក្នុងការក្លាយជាកោសិកា totipotent ឬកោសិកា pluripotent ។ កោសិកា hepatocytes ច្រើន និង hepatocytes unipotent ជួនកាលត្រូវបានគេហៅថាកោសិកាដើម។
លេខយោង
កែប្រែមានយន្តការពីរដើម្បីធានាថាចំនួនកោសិកាដើមត្រូវបានរក្សា។ មួយ។ ការចម្លងតាមកោសិកាដើមមិនស្មើគ្នាសំខាន់ៗ៖ កោសិកាដើមមួយបែងចែកទៅជាកោសិកាមេមួយដូចគ្នាបេះបិទទៅនឹងកោសិកាដើមដើម និងកោសិកាកូនស្រីដែលបែងចែកខុសគ្នា។ ២. ភាពខុសគ្នានៃ Stochastic: នៅពេលដែលកោសិកាដើមមួយបែងចែកទៅជាកោសិកាកូនស្រីពីរ កោសិកាដើមផ្សេងទៀតឆ្លងកាត់ ការ mitosis ហើយបង្កើតកោសិកាដើមពីរដូចគ្នាបេះបិទទៅនឹងដើម។
ការបន្តខ្លួនឯង
កែប្រែនៅក្នុងការអនុវត្តជាក់ស្តែង កោសិកាដើមត្រូវបានកំណត់អត្តសញ្ញាណដោយថាតើពួកគេអាចបង្កើតជាលិកាឡើងវិញបានដែរឬទេ។ ឧទាហរណ៍ ការធ្វើតេស្តកំណត់សម្រាប់ខួរឆ្អឹង ឬ កោសិកាដើម hematopoietic (HSC) គឺដើម្បីប្តូរកោសិកា និងរក្សាទុកពួកវាជាបុគ្គលដោយគ្មានកោសិកាដើម hematopoietic ។ នេះបង្ហាញថាកោសិកាអាចបង្កើតកោសិកាឈាមថ្មីក្នុងរយៈពេលយូរ។ វាក៏អាចធ្វើទៅបានដើម្បីញែកកោសិកាដើមដែលអាចត្រូវបានប្តូរទៅបុគ្គលផ្សេងទៀតដោយគ្មាន HSC ពីបុគ្គលដែលបានប្តូរ។
លក្ខណៈនៃកោសិកាដើមអាចត្រូវបានបង្ហាញនៅក្នុងមន្ទីរពិសោធន៍ដោយប្រើវិធីសាស្ត្រដូចជា ការធ្វើតេស្ត clonogenic ដែលវាយតម្លៃកោសិកាតែមួយតាមរយៈ សមត្ថភាពនៃភាពខុសគ្នា និង ការចម្លងដោយខ្លួនឯង។ កោសិកាដើមក៏អាចត្រូវបានញែកដាច់ពីគេដោយមានចំនួនប្រជាជនជាក់លាក់នៃសញ្ញាសម្គាល់ផ្ទៃកោសិកា។ ទោះជាយ៉ាងណាក៏ដោយ លក្ខខណ្ឌវប្បធម៌នៅក្នុង vitro ផ្លាស់ប្តូរឥរិយាបថរបស់កោសិកា ដែលធ្វើឱ្យវាមិនច្បាស់លាស់ពីរបៀបដែលកោសិកាមានឥរិយាបទពិតប្រាកដ។ មានការជជែកវែកញែកយ៉ាងសន្ធឹកសន្ធាប់ថាតើកោសិកាដើមពេញវ័យមួយចំនួនពិតជាកោសិកាដើមឬអត់។ [ ប្រភពទាមទារ ]</link></link>
កាលប្បវត្តិ
កែប្រែប្រភេទ
កែប្រែភាពអមតៈ និង ភាពច្រើន នៃកោសិកាដើម ផ្តល់នូវគំរូល្អក្នុង vitro សម្រាប់ការសិក្សាអំពីការអភិវឌ្ឍន៍មនុស្ស។ តាមរយៈការសិក្សាពីដំណើរការនៃភាពខុសគ្នានៃកោសិកាដើម ហ្សែន ដែលដើរតួនាទីក្នុងការអភិវឌ្ឍន៍ និងដំណើរការបែងចែកនឹងត្រូវបានបង្ហាញ ហើយការស្រាវជ្រាវនេះត្រូវបានគេរំពឹងថានឹងបង្កើនល្បឿននៅពេលដែល ផែនទីហ្សែន របស់មនុស្សត្រូវបានបញ្ចប់។ លើសពីនេះ ការអភិវឌ្ឍន៍ថ្នាំថ្មីនឹងកាន់តែសកម្ម នៅពេលដែលការធ្វើតេស្តថ្នាំ និងការធ្វើតេស្តជាតិពុលត្រូវបានអនុវត្តលើជាលិកា ឬ កោសិកា របស់មនុស្សដែលមានភាពដូចគ្នាដែលទទួលបានពីកោសិកាដើម។ ទោះជាយ៉ាងណាក៏ដោយ សំខាន់ជាងនេះទៅទៀត តម្លៃដ៏អស្ចារ្យបំផុតនៃកោសិកាដើមនាពេលអនាគតគឺថា វាអាចទៅរួចដើម្បីទទួលបាននូវបរិមាណដ៏ធំនៃកោសិកា ឬជាលិកាដែលអាចជំនួសជាលិកាដែលខូច ហើយប្រើវា ដើម្បីព្យាបាលជំងឺដែលមិនអាចព្យាបាលបាន ។ ឧទាហរណ៍ ជំងឺផាកឃីនសុន ដែលជាជំងឺខួរក្បាលដែលខូច បណ្តាលមកពីការស្លាប់នៃកោសិកាសរសៃប្រសាទដែលផលិត សារធាតុ dopamine ហើយការប្តូរជាលិកាខួរក្បាលរបស់ទារកត្រូវបានគេដឹងថាជាវិធីសាស្ត្រព្យាបាលដ៏មានប្រសិទ្ធភាពបំផុត។ ទោះជាយ៉ាងណាក៏ដោយ ជាលិកាខួរក្បាលរបស់ទារកមិនត្រឹមតែមានកម្រិតប៉ុណ្ណោះទេ ថែមទាំងបង្កបញ្ហាសីលធម៌ និងសង្គមជាច្រើនទៀតផង។ តាមរយៈការបង្កើតវិធីសាស្រ្តដើម្បីជំរុញឱ្យមានភាពខុសគ្នានៃកោសិកាណឺរ៉ូន dopaminergic ពីកោសិកាដើម វានឹងអាចទទួលបានបរិមាណដ៏ច្រើននៃកោសិកាសរសៃប្រសាទ dopaminergic ហើយប្តូរពួកវាទៅជាអ្នកជំងឺ ដែលមានជំងឺផាកឃីនសុន ។ លើសពីនេះទៀត ប្រសិនបើកោសិកា β ជាច្រើនដែលបញ្ចេញអាំង ស៊ុយលីន ត្រូវបានទទួល នោះវានឹងអាចព្យាបាលអ្នកជំងឺដែលមាន ជំងឺទឹកនោមផ្អែម ប្រភេទទី 1 ដែលពឹងផ្អែកលើការចាក់ អាំងស៊ុយលីន ។ លើសពីនេះ តម្លៃនៃឱសថបង្កើតឡើងវិញកំពុងកើនឡើងជាលំដាប់ ដោយសារក្តីសុបិននៃឱសថបង្កើតឡើងវិញអាចរៀបចំឡើងវិញនូវទីផ្សារវេជ្ជសាស្ត្រពិភពលោកបច្ចុប្បន្នទាំងមូល ដែលមានតម្លៃប្រហែល 120 quintillion។
ការអភិវឌ្ឍន៍នៃការព្យាបាលសម្រាប់អ្នកជំងឺដាច់សរសៃឈាមខួរក្បាលរបស់មនុស្សកំពុងដំណើរការ រួមទាំងការរកឃើញអ្នកសម្របសម្រួលការព្យាបាលដោយកោសិកាដើម ដើម្បីព្យាបាលជំងឺដាច់សរសៃឈាមខួរក្បាល ( ជំងឺដាច់សរសៃឈាមខួរក្បាល ) ក្នុងដំណាក់កាលធ្វើតេស្តសត្វ។ [៧] នៅក្នុងករណីនៃការបង្កើតឡើងវិញនៃ ឆ្អឹងខ្ចី ជង្គង់ ឆ្អឹង និងឆ្អឹងខ្ចីត្រូវបានបង្កើតឡើងវិញនៅក្នុងសត្វទន្សាយដោយដុំកោសិកាដើមទៅជាអង្កាំ ហើយស្ទូងពួកវាទៅក្នុងជង្គង់ដើម្បីបង្កើតជាលិកាសិប្បនិម្មិត។ [៨]
អាគុយម៉ង់
កែប្រែកោសិកាដើមត្រូវបានគេរំពឹងថានឹងបើកការយល់ដឹងថ្មីសម្រាប់មនុស្សជាតិ រួមទាំងទិដ្ឋភាពផ្នែកវេជ្ជសាស្រ្តផងដែរ។ ទោះជាយ៉ាងណាក៏ដោយ ដោយសារតែធម្មជាតិនៃកោសិកាដើមដោយប្រើអំប្រ៊ីយ៉ុងរបស់មនុស្ស ការជជែកវែកញែកទាក់ទងនឹងសេចក្តីថ្លៃថ្នូររបស់មនុស្សហាក់ដូចជាជៀសមិនរួច ហើយភាពចម្រូងចម្រាសផ្សេងៗនៅតែបន្តកើតមាន។
- ភាពចម្រូងចម្រាសលើការប្រើប្រាស់ទារក
ដើម្បីឱ្យការស្រាវជ្រាវកោសិកាដើមដំណើរការ កោសិកាដើមត្រូវតែត្រូវបានស្រង់ចេញដោយប្រើ blastocysts ។ ទោះបីជាយ៉ាងណាក៏ដោយ មានការជជែកដេញដោលគ្នាជាបន្តបន្ទាប់ថាតើជីវិតមនុស្សត្រូវបានគេយកទៅធ្វើការពិសោធន៍ដែរឬទេ ព្រោះវាអាចត្រូវបានបង្ហាញថាជាទារក។ ក្នុងន័យនេះ ការជជែកវែកញែកអំពីសាសនា ឬជំនឿមិនអាចត្រូវបានគេព្រងើយកន្តើយឡើយ។ ជាមូលដ្ឋាន ការជជែកវែកញែកពាក់ព័ន្ធនឹងសំណួរថាតើ blastocysts អាចត្រូវបានចាត់ទុកថាជាជីវិតឬអត់។
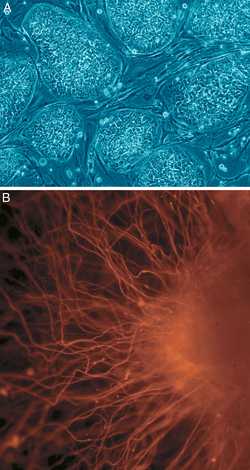
រូបថត
កែប្រែប្រទេសភាគច្រើនបានអនុម័តច្បាប់ជីវសីលធម៌ ហើយកូរ៉េមាន ច្បាប់ស្តីពីជីវសីលធម៌ និងសុវត្ថិភាព ។ ច្បាប់នេះហាមឃាត់ការប្រើប្រាស់ អំប្រ៊ីយ៉ុង (អំប្រ៊ីយ៉ុងស្រស់) ដែលអាចលូតលាស់ទៅជាសារពាង្គកាយមានជីវិតដើម្បីបង្កើត កោសិកាដើមអំប្រ៊ីយ៉ុង ។ នេះគឺដោយសារតែអំប្រ៊ីយ៉ុងត្រូវបានបំផ្លាញដោយជៀសមិនរួចនៅពេលដែលកោសិកាដើមត្រូវបានស្រង់ចេញ។ ដូច្នេះមានតែមេជីវិតឈ្មោល និងស៊ុតមិនទាន់បង្កកំណើត (ស៊ុតមិនទាន់បង្កកំណើត) ឬអំប្រ៊ីយ៉ុងដែលនៅសល់ក្រោយការព្យាបាលភាពគ្មានកូន ហើយគ្រោងនឹងបោះចោល (អំប្រ៊ីយ៉ុងកក) អាចប្រើបាន។ [៩] ការស្រាវជ្រាវមិនអាចធ្វើបានជាមួយស៊ុតអ្នកបរិច្ចាគទេ។ លោកវេជ្ជបណ្ឌិត Hwang Woo-seok បានប្រើស៊ុតអ្នកបរិច្ចាគ ប៉ុន្តែនេះគឺមុនពេលដែលច្បាប់ត្រូវបានកែសម្រួល។
ទោះជាយ៉ាងណាក៏ដោយ សហរដ្ឋអាមេរិកអនុញ្ញាតឱ្យស្រាវជ្រាវដោយប្រើស៊ុតអ្នកបរិច្ចាគ។ នៅខែមិថុនាឆ្នាំ 2006 សាកលវិទ្យាល័យ Harvard បានចាប់ផ្តើមការស្រាវជ្រាវការក្លូនអំប្រ៊ីយ៉ុង somatic ដោយប្រើស៊ុតម្ចាស់ជំនួយ។ [១០] ក្នុងឆ្នាំ 2013 ពួកគេបានជោគជ័យក្នុងការក្លូនកោសិកាដើមអំប្រ៊ីយ៉ុងក្នុងរយៈពេល 9 ឆ្នាំដោយប្រើវិធីសាស្ត្រស្ទើរតែស្រដៀងនឹងវិធីសាស្ត្រស្រាវជ្រាវរបស់វេជ្ជបណ្ឌិត Woo-Seok Hwang (វិធីសាស្ត្រស្រាវជ្រាវរបស់ Dr. Woo-Seok Hwang ធ្លាប់ត្រូវបានប្រើប្រាស់ដោយអ្នកស្រាវជ្រាវ stem cell ពីមុន ហើយ Dr. វិធីសាស្ត្ររបស់ Woo-Seok Hwang ត្រូវបានគេចាត់ទុកថាជា "ពិសេស" ។ 'ខ្ញុំមិនអាចធ្វើវាបានទេ ') លើកនេះផងដែរ ដូចជាវេជ្ជបណ្ឌិត Hwang Woo-seok ស៊ុតអ្នកបរិច្ចាគក៏ត្រូវបានគេប្រើផងដែរ។
ការរើសអើង
កែប្រែ- លោក Hwang Woo-seok
- meristem
- ចន ហ្គរដុន
- ការព្យាបាលដោយកោសិកា
- Shinya Yamanaka
- madang.ajou.ac.kr/~ydpark/lectures/... /S20050609PCW.ppt
- kdcp.halym.or.kr/education/StemCell05.ppt
- biosci.snu.ac.kr/includes/download.php?file=2-2
- នាយកគ្លីនិកស្ត្រី Avenue Cho Byeong-gu [ ការបញ្ចេញមតិមិនច្បាស់ ]
- សព្វវចនាធិប្បាយ Doosan Donga
- Alessandra Biffi (2013) ។ "ការព្យាបាលដោយហ្សែនកោសិកាដើម hematopoietic lentiviral ផ្តល់អត្ថប្រយោជន៍ដល់ជំងឺមហារីកឈាម metachromatic" វិទ្យាសាស្រ្ត 341 (6148) doi: 10.1126/science.1233158
- Florian Eichler (2017) ។ "ការព្យាបាលដោយហ្សែន Stem-Cell Hematopoietic សម្រាប់ Cerebral Adrenoleukodystrophy" The New England Journal of Medicine 377 :1630-1638 DOI: 10.1056/NEJMoa1700554
- Juli R. Bagó (2016) ។ "កោសិកាដើមសរសៃប្រសាទដែលបង្កើតដោយវិស្វកម្មព្យាបាលគឺជាដុំសាច់ដុះ និងរារាំងការវិវត្តនៃ glioblastoma" Nature Communications 7 :10593 doi: 10.1038/ncomms10593។
ច្បាប់ជីវសីលធម៌
កែប្រែ- ↑ Allessandra Biffi(2013). "Lentiviral hematopoietic stem cell gene therapy benefits metachromatic leukodystrophy" Science 341(6148) doi: 10.1126/science.1233158
- ↑ Florian Eichler(2017). "Hematopoietic Stem-Cell Gene Therapy for Cerebral Adrenoleukodystrophy" The New England Journal of Medicine 377:1630-1638 DOI: 10.1056/NEJMoa1700554
- ↑ Zhanhui Ou(2016). "The Combination of CRISPR/Cas9 and iPSC Technologies in the Gene Therapy of Human β-thalassemia in Mice" Scientific Reports 6:32463 doi:10.1038/srep32463
- ↑ Juli R. Bagó(2016). "Therapeutically engineered induced neural stem cells are tumour-homing and inhibit progression of glioblastoma" Nature Communications 7:10593 doi: 10.1038/ncomms10593
- ↑ Jana Portnow(2017). "Neural Stem Cell–Based Anticancer Gene Therapy: A First-in-Human Study in Recurrent High-Grade Glioma Patients" Clinical Cancer Research 23(12):2951-2960 doi: 10.1158/1078-0432.CCR-16-1518
- ↑ Ryosuke Uchibori(2014). "Cancer gene therapy using mesenchymal stem cells" International Journal of Hematology 99(4): 377-82 https://doi.org/10.1007/s12185-014-1537-7
- ↑ 이재원 (2021-09-27). "뇌경색 줄기세포치료 새로운 매개물질 발견". 의학신문. http://www.bosa.co.kr/news/articleView.html?idxno=2158982http://www.bosa.co.kr/news/articleView.html?idxno=2158982.
- ↑ 김만기 (2021-12-05). "줄기세포로 뼈·연골을 한번에 만들었다". 파이낸셜뉴스. https://news.naver.com/main/read.naver?mode=LSD&mid=sec&oid=014&aid=0004750453&sid1=001.
- ↑ http://news.naver.com/main/read.nhn?mode=LSD&mid=sec&sid1=105&oid=038&aid=0002145700
- ↑ http://news.naver.com/main/read.nhn?mode=LSD&mid=sec&sid1=105&oid=003&aid=0000585796